アルツハイマー病(AD)の治療が困難を極めています。新薬もイバラの道です。そんな中で、従来のAβ説とは別の原因説が注目されています。いくつかある中で、今回は脳のグリア細胞に見つかったニコチン酸受容体(GPR109AまたはHcar2ともいう)について、現状をまとめます。長文ですが最後まで読めば役に立ちますよ。
●脳には神経細胞の他に3種類のグリア細胞が詰まっている(詳しくは → こちら)。
これらの細胞の大まかな形を図1に示します。図右の四角の中には、他の論文の知見を含めて、コーヒー成分との関わりが書いてあります。先ずはこれをお読みください。

脳の細胞はある種の秩序を保って繋がりあって、情報の伝達、判断、理解、記憶などの精神活動を迅速にかつ精密に行っています。これらの働きのどれかが損なわれると認知障害の始まりです。詳細は理化学研究所HPをご覧ください(詳しくは → こちら)。
●加齢性のADモデルマウスではアストロサイトに2型アデノシン受容体(A2AR)が増えている。
ADの脳では、正常脳には見られないアストロサイトの病的変化が起こっています。アストロサイトの機能が変化すると、神経間の情報伝達にも影響が及びます。神経間の情報伝達は、2つの神経細胞の接合部位(シナプスと呼ぶ)で起こっていて、そのシナプスを覆うようにアストロサイトが被さって、何か重要な役割を果たしているのです(図2)(詳しくは → こちら)。しかしその中身は未だほとんど解っていません。さらに複雑で巧妙な繋がりは、後述するアストロサイトとミクログリアの間にもあって、今その一端が分かり始めたところです。

ADのアストロサイトが何をやっているのかを調べた研究は沢山あります。そのなかにコーヒー成分に関係するものを探してみました。すると、2021年にポルトガルの神経科学研究センターが発表した論文に、アデノシン受容体のA2ARのことが書いてありました(詳しくは → こちら)。
この論文によりますと、2型糖尿病その他のリスク因子で刺激された脳は、アストロサイトを増やし、しかもその細胞表面にA2ARを大量に発現しているとのことです(図3)。この受容体に、睡眠物質の1つである小さな分子アデノシンが結合すると、神経細胞に好ましくない変化が起こるというのです。しかしここで、アデノシンの代わりにコーヒー成分のカフェインが結合すると、その変化の少なくとも一部が抑えられると考えられるのです。ADとの関係は希薄ですが、「カフェインの眠気防止効果」は良く知られたコーヒーの効き目です。

●アストロサイトはインターロイキン-3(IL-3)を放出してミクログリアと情報交換している(詳しくは → こちら)。
この論文はハーバード大学の研究者が2021年にネイチャー誌に掲載したもので、日本でも専門家の関心を呼びました。神経細胞と情報交換しているアストロサイト(図2を参照)が、さらにミクログリアと交信しているのです(図4)。これは一体何を意味しているのでしょうか?

この論文では、IL-3で刺激されたミクログリアが、ADリスクを高めるAβタンパク質の周囲に集まって、何らかの方法(分解するとか排出するとか)で除去していると説明しています。
この論文とは別に、アストロサイトがミクログリアを介さずに、直接Aβを分解除去するメカニズムが、2018年の日本人の論文に見つかります(詳しくは → こちら)。

図5をご覧ください。神経細胞が作るAβをそのまま放置すると老人斑となって沈着し、やがて神経細胞を殺してADを起こすとされています。そうならないように、Aβが増えると、その刺激がグルタミン酸シグナルとなってアストロサイトに伝わります。すると、アストロサイトはAβ分解酵素(緑色のKLK7)を放出してAβを分解除去するというのです。
以上の2つのメカニズム(図4と5)は、どちらもAD治療薬開発に応用できると考えられて、従来薬とは異なる新薬への道が模索されています。
それでは次にミクログリアについて説明します。
●ADモデルマウスではミクログリアのニコチン酸受容体が増えている(詳しくは → こちら)。
ごく最近になって、米国インディアナ大学の研究者らは、加齢性ADのモデルマウス(日本でも市販されている5×FADマウスのこと)の脳で、ニコチン酸受容体(GPR109A)が正常マウスの数十倍も増えていることを見出しました(図6の青:赤)。GPR109AはHcar2とも呼ばれる受容体で、ニコチン酸の他に酪酸やヒドロキシ酪酸などの小さなカルボン酸の受容体です。コーヒーの香り成分にも10種類程度のリガンドがしられています。ニコチン酸と酪酸は、共に腸内菌が産生する代謝物で、最近話題の「腸-脳関連」にも関わっている分子です(詳しくは → こちら)。
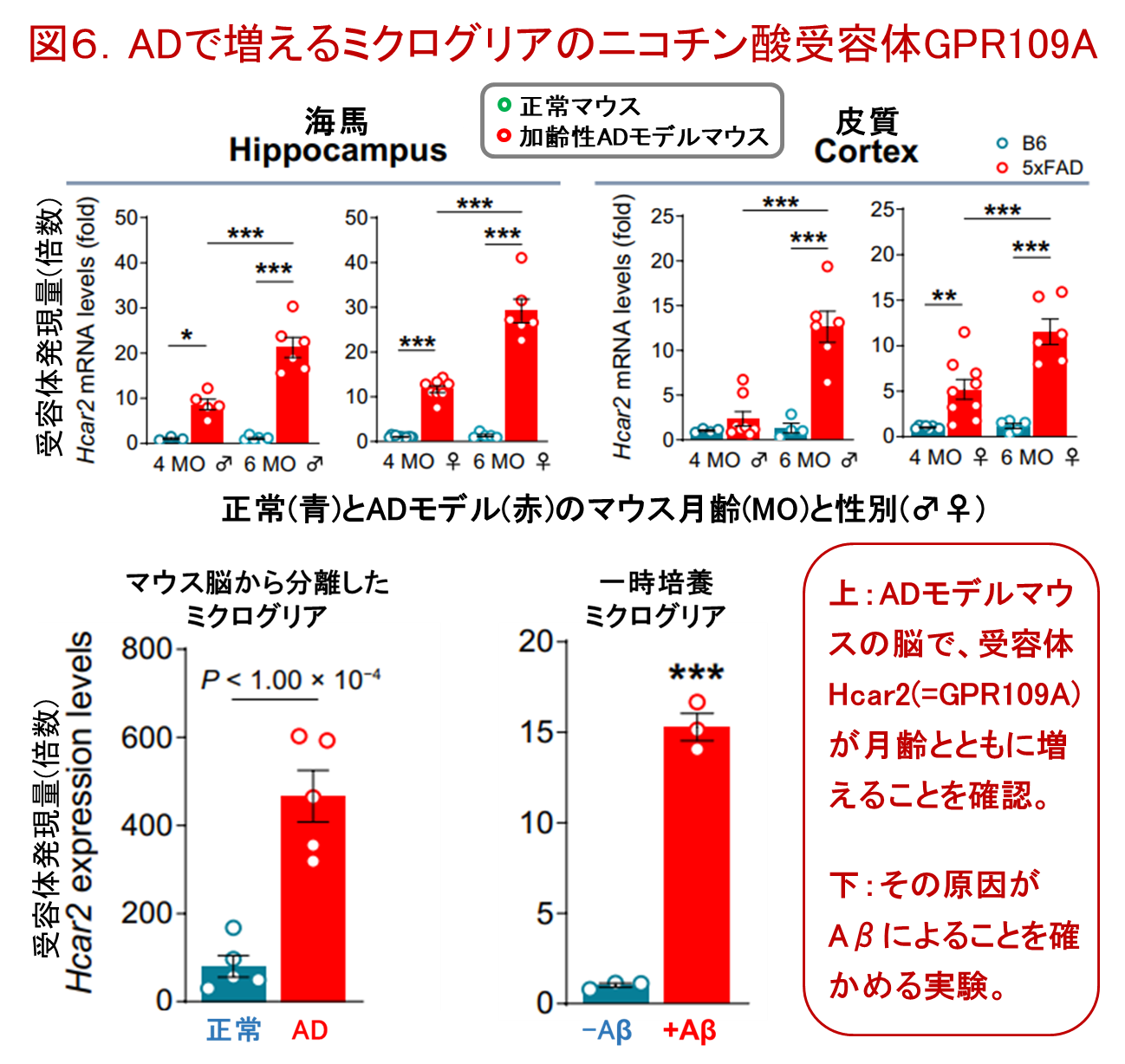
図6の上の段から説明しましょう。正常マウス(青色)とADマウス(赤色)を同じ環境で飼育しながら、4ヶ月と6ヶ月の時点で、海馬と皮質の受容体量を測定して比較しました。受容体は月齢とともに増えましたが、性差は少なくほぼ同じ変化でした。次に、受容体が増える理由を調べた実験が下段のグラフです。その左は、マウスの脳から分離した直後のミクログリアを調べた結果で、ADマウスは正常マウスの約5倍の受容体をもっていました。次にこのミクログリアを、ADの原因タンパク質であるAβを加えた培地で培養してみると、右グラフのように、Aβが受容体の量を増やしているという結果が得られたのです。
ではこの受容体は、ADの脳でどんな役割を果たしているのでしょうか?
●ADの脳にニコチン酸や酪酸が豊富にあるとは考えにくい。
もし筆者のこの推測が当たっていれば、ADの脳は受容体の数を増やすことで、「少ないながらも周囲にあるニコチン酸と酪酸を1つ残らず捕えようとしている」のではないでしょうか?もしそうだとすれば、ニコチン酸も酪酸もADの脳機能を回復する方向で作用すると考えられるのです。そこでインディアナ大学の研究者らは、ニコチン酸製剤の投与実験を実施しました。
●加齢性ADモデルマウスにニコチン酸(NA:Niaspan®)を投与した(詳しくは → こちら)。

Niaspan®を60日間投与した結果、Y字迷路テスト(詳しくは → こちら)の結果が、正常マウスと同程度まで回復しました。動物実験といえども、この結果はこれまでにない好成績で、原因に合わせた治療の成績が見事に一致したのです。言い換えると、この実験結果はヒトでも再現できるとの期待が膨らみます。しかし現在、世界の多くの研究者は、ニコチン酸受容体には目もくれず、「ニコチン酸から体内でできるNAD」を増やすことを目標に頑張っているのです。
●ADの脳神経変性ではNADが不足している(詳しくは → こちら)。
2021年に発表されたこの総説論文では、過去に発表された論文を全部まとめた上で、「ADの脳でNADが不足していることは確かな事実である」と強調しています。ですから「NAD前駆体を投与して脳内のNADを増やせばADは治療できる」と多くの研究者が考えているのです。動物実験は確かに成功しつつあります。しかし動物の実験がヒトで再現できないことはよくあることです。この場合も、実は以前からヒト試験が行われてきましたが、「ヒトの脳のNADが増えた」という確かなデータは未だありません。前駆体(ブースターとも呼ばれる)の選択が最適でないのか、投与量/投与法に工夫が足りないのか・・・それもよく分からない状況です。
ここで、AD治療とは離れますが、現在ある4つのブースターを、脂質代謝改善のヒト試験で比較したデータを見てみましょう。
●脂質代謝改善のヒト試験で効果が認められたのはニコチン酸だけ(詳しくは → 第471話)。
何故そうなるかと言いますと、脂質代謝改善を強力に実現できる薬理作用は、4つのブースターのうちニコチン酸だけが持つ受容体GPR109Aの働きだからです(図8)。他の3つがこの受容体に結合することはありませんし、これに似た受容体があるわけでもありません。筆者が言いたいことは、脂質代謝は全身の細胞で起こりますが、「似た現象がADのミクログリアの受容体でも起こり得る」ということです。そしてその結果、図7のデータが示すような、ADの改善にとって好ましい変化が脳の中で起こるのではないでしょうか?

では、モデルマウスではなく、ヒトでミクログリアの受容体を活性化するのに必要なニコチン酸の投与量を考えてみましょう。その量は基本的に脂質代謝改善に要した量と同じはずです。その量とは、ビタミンとしての1日必要量10~20㎎の、少なくとも10倍以上に相当する数百㎎ということになります。コーヒー1杯(深煎り豆10g)には最大5㎎が含まれていますが、数百㎎を摂るには少な過ぎる量なのです。ですから仮に毎日のコーヒーがADになるリスクを下げるとしても、コーヒーでADを治療することはできません。どうしても薬としてのニコチン酸が必要です。近い将来に、世界の誰かが、AD患者を対象にしてニコチン酸の臨床試験を実施することを期待して待つしかないのです。
最後に、ADの新治療薬に繋がるかも知れないもう1つの学説です。
●図1のアストロサイトに添えてあるAQP4(アクアポリン4)については、別途に項を改めて紹介します。
(第472話 完)




 2025/03/12
2025/03/12
 2025/03/15
2025/03/15
 2025/03/01
2025/03/01
